Questão 01 sobre Rendimento Químico: (Ufam AM/2008). A reação de combustão do monóxido de carbono é dada pela equação:
CO(g) + ½ O2(g) à CO2(g)
Considere que esta reação ocorra em um sistema mantido nas CNTP e inicia-se a partir de seis litros de uma mistura estequiométrica de monóxido e oxigênio. Qual o volume total do sistema quando 50% do CO2 tiver sido formado?
a) 2,0 litros
b) 5,0 litros
c) 3,0 litros
d) 4,0 litros
e) 1,5 litro
Questão 02. (Ufpe PE/2008)A preocupação com o meio ambiente levou ao desenvolvimento de metodologias verdes (pouco poluentes), que procuram reduzir a produção de rejeitos e a utilização de reagentes tóxicos. Um exemplo de metodologia verde é a síntese descrita abaixo do ácido adípico, utilizado na preparação do náilon-66. Considere as massas molares do cicloexeno e do ácido adípico iguais a 82 e 146 g·mol–1, respectivamente.
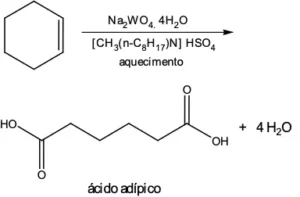
Calcule a massa de em kg que será formada a partir de 41 kg de cicloexeno, considerando que o rendimento da reação é 85%. Assinale o número inteiro mais próximo.
Questão 03 sobre Rendimento Químico: (Uepg PR/2007/Julho).Muitos metais reagem com os halogênios produzindo o haleto metálico correspondente. O ferro, por exemplo, reage com o cloro, formando o cloreto de ferro (III). Considerando-se esta reação, assinale o que for correto:
Dados de massa atômica: Fe: 56,0 u; Cl: 35,5 u.
01. Se inicialmente forem utilizados 56 g de Fe será obtido 0,5 mol de cloreto férrico.
02. Se, ao final da reação entre 2 mols do metal e 3 mols do halogênio, forem obtidos 162,5 g de cloreto férrico, o rendimento da reação será de 45%.
04. A equação equilibrada que representa esta reação é: ![]() .
.
08. A reação entre o ferro e o cloro é uma reação de oxi-redução, na qual o ferro é oxidado a Fe3+.
16. Se a massa inicial do ferro for 11,2 g, serão necessários 71 g de cloro para que a reação se complete.
Questão 04. (Unifesp SP/2007/2ªFase) A prata é um elemento muito utilizado nas indústrias de fotografia e imagem e seu descarte no meio ambiente representa risco para organismos aquáticos e terrestres. Por ser um dos metais com risco de escassez na natureza, apresenta um alto valor agregado. Nesses aspectos, a recuperação da prata de resíduos industriais e de laboratórios associa a mitigação do impacto ambiental à econômica. O fluxograma representa o tratamento de um resíduo líquido que contém íons de prata (Ag+) e de sulfato (![]() ) em meio aquoso.
) em meio aquoso.
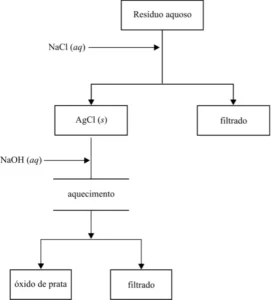
a) Escreva as equações das reações, devidamente balanceadas, da formação do cloreto de prata e do óxido de prata.
b) No tratamento de um resíduo aquoso que continha 15,6 g de sulfato de prata, foram obtidos 8,7 g de óxido de prata. Calcule o rendimento em Ag2O deste processo.
Questão 05. (Ufc CE/2007/2ªFase). O manganês é um metal de transição com elevada importância na indústria siderúrgica, sendo utilizado na composição de ligas metálicas para a produção de aço. Na natureza, sua principal fonte é o minério pirolusita (MnO2), que é empregado para a obtenção de ferromanganês, de acordo com a seguinte reação:
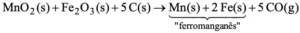
a) Quantos elétrons estão envolvidos nessa reação?
b) Em uma reação com 70% de rendimento, qual é a massa (em gramas) de ferro que é obtida a partir de 173,8 g de pirolusita com 20% de impurezas?
Questão 06 sobre Rendimento Químico: (Uftm MG/2007/2ªFase) Na indústria, o gás oxigênio é obtido pela liquefação do ar e por um processo posterior, o qual separa o oxigênio do nitrogênio e de outros gases do ar. No laboratório, o oxigênio pode ser obtido a partir de um esquema representado na figura, que envolve a decomposição do clorato de potássio em cloreto de potássio (KCl) e O2.
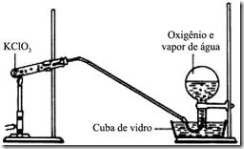
a) Calcule o rendimento percentual da reação, sabendo-se que foram coletados 144 g de gás oxigênio a partir da decomposição de 490 g de clorato de potássio, que tem massa molar 122,5 g/mol.
b) Determine o número de oxidação do cloro no clorato e dê o nome do processo industrial da separação do oxigênio de outros gases do ar.
Questão 07. (Uepb PB/2007) O óxido nitroso é usado como anestésico em partos. A sua obtenção é dada pela reação apresentada na equação química abaixo:
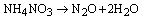
Se foram usados 6 gramas de nitrato de amônio e foram obtidos 2,97 g de óxido de dinitrogênio, qual o rendimento da reação?
a) 91%
b) 110%
c) 97%
d) 90%
e) 80%
Questão 08. (Ueg GO/2006/Julho). O gás hidrogênio é utilizado como combustível nas missões espaciais. Ele é obtido industrialmente a partir da decomposição catalítica dos hidrocarbonetos. Em laboratório, ele pode ser preparado reagindo-se ferro metálico e ácido sulfúrico.
Sobre este assunto, responda ao que se pede:
a) Cite uma vantagem que justifique o uso do hidrogênio como combustível.
b) Dê a equação de formação de síntese do gás hidrogênio a partir de ferro metálico e ácido sulfúrico.
c) Ao reagir 224 kg de ferro metálico com ácido sulfúrico em excesso, qual o volume de gás hidrogênio é produzido se a reação apresentar 75% de rendimento?
Questão 09. (Ufms MS/2007/Biológicas) A região da serra da Bodoquena/MS desperta interesse da indústria de fertilizantes, por possuir reservas de fosfato de cálcio em suas rochas. Durante o processo de fabricação dos fertilizantes, é adicionado ácido sulfúrico ao fosfato, que sofre a seguinte reação não balanceada:
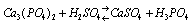
Calcule a massa, em toneladas, de H3PO4 obtida a partir de 15,5 toneladas de fosfato de cálcio, considerando que o processo apresenta um rendimento de 51,03%.
Dados: Massas Molares (g/mol): H = 1; O = 16; S = 32; P = 31; Ca = 40.
Questão 10 sobre Rendimento Químico: (Unifesp SP/2006/1ªFase). No laboratório de química, um grupo de alunos realizou o experimento esquematizado na figura, que simula a fabricação do bicarbonato de sódio, um produto químico de grande importância industrial.
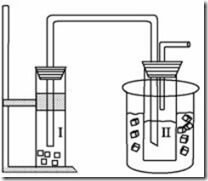
O frasco II, imerso em um banho de água e gelo, contém solução aquosa com carbonato de amônio e 23,4 g de cloreto de sódio. O frasco I, gerador de gás carbônico, contém “gelo seco”, que quando borbulhado na solução do frasco II causa uma reação, produzindo como único produto sólido o bicarbonato de sódio. Decorrido o tempo necessário de reação, os cristais foram separados e secados, obtendo-se 25,2 g de NaHCO3. Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a:
a) 85%.
b) 80%.
c) 75%
d) 70%.
e) 39%.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das 10 questões sobre Rendimento Químico:
01. B
02. 62
03. 12
04. a) 2NaCl(aq) + Ag2SO4(aq) -> 2AgCl(s) + Na2SO4(aq)
2AgCl(s) + 2NaOH(aq) ![]() Ag2O(s) + NaCl(aq) + H2O(l)
Ag2O(s) + NaCl(aq) + H2O(l)
b) 75%
05. a) De acordo com a reação balanceada, há variação no nox do Mn de +4 para 0 e, no nox do Fe, de +3 para 0, perfazendo um total de dez elétrons. Igual número é observado na variação do nox do C, que passa de 0 para +2.
06. a) 75%
b) 5+; destilção fracionada
07. D
08.
a) Durante a combustão, não há impacto ambiental, ou seja, é produzido água ![]()
c) 67,2 L
09. 005;
10. C;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
