Questão 01 sobre Funções Químicas Bases: (Ufscar SP/2002/1ªFase). O reboco das paredes de casas pode ser feito com a aplicação de uma pasta feita de argamassa com água.
A argamassa é uma mistura de areia com cal extinta, Ca(OH)2. Nas paredes, a pasta vai endurecendo devido à evaporação da água e subseqüente reação do hidróxido de cálcio com o gás carbônico do ar. O reboco seco é constituído por uma mistura rígida de areia e:
a) Ca3(PO4)2.
b) CaSiO3.
c) CaSO4.
d) Ca(HCO3)2.
e) CaCO3.
Questão 02. (Ufg GO/1992/1ªFase). O Mg(OH)2 em água (leite de magnésia) é consumido popularmente como laxante e antiácido. De acordo com a equação a seguir, pode-se afirmar que o Mg(OH)2.
Mg(OH)2 (s) + H2O (ℓ) ® Mg2+ + 2OH– (aq)
01. é uma substância básica;
02. em água é pouco solúvel;
04. em água produz uma solução neutra;
08. em água produz um (1) cátion e dois (2) ânions;
16. tem duas (2) cargas positivas e uma (1) negativa;
32. em água é um processo químico.
Questão 03. (ITA SP/2000) Num tubo de ensaio dissolve-se açúcar em água e acrescenta-se uma porção de fermento biológico do tipo utilizado na fabricação de pães. Após certo tempo observa-se a liberação de gás nesta mistura. O borbulhamento deste gás em uma solução aquosa não saturada em Ba(OH)2 provoca, inicialmente, sua turvação. Esta desaparece com o borbulhamento prolongado do gás. A respeito das descrições feitas nestes experimentos são feitas as seguintes afirmações:
I. o produto gasoso formado, e responsável pela turvação inicial da solução de Ba(OH)2, é o monóxido de carbono (CO).
II. o produto gasoso formado, e responsável pela turvação inicial da solução de Ba(OH)2 é o etanol.
III. a turvação inicial da solução de Ba(OH)2 é justificada pela precipitação de Ba(HCO3)2(c).
IV. o desaparecimento da turvação inicial da solução de Ba(OH)2 é justificada pela reação química representada pela seguinte equação:
Ba(OH)2(c) + HCO-3(aq) ® BaCO3(aq) + H2O(aq) + OH-(aq)
Das informações acima estão ERRADAS:
a) apenas I e III.
b) apenas I e V.
c) apenas II e IV.
d) apenas II, IV e V
e) todas
Questão 04 sobre Funções Químicas Bases: (Mackenzie SP/2001) Na reação entre os gases N2 e H2 , obtém-se unicamente gás amônia. A solução aquosa de amônia recebe o nome de amoníaco (hidróxido de amônio), que é o componente ativo de produtos de limpeza usados para remoção de gorduras.
A partir dessas informações, considere as seguintes afirmações:
I. O hidróxido de amônio tem fórmula NH3 .
II. Na formação do gás amônia, a reação ocorrida é de síntese.
III. O amoníaco tem fórmula NH4OH .
IV. A amônia tem fórmula NH4OH .
V. O cheiro irritante e forte, que se sente quando se usa amoníaco, é proveniente do gás nitrogênio.
Estão corretas, somente:
a) I e IV .
b) II e V .
c) II e III .
d) I e II .
e) III e V.
Questão 05. (Puc RS/2005/Julho). Sobre os elementos químicos genéricos X e Y que apresentam as distribuições eletrônicas:
X = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Y = 1s2 2s2 2p4
é correto afirmar que:
a) X forma íon de carga 2-.
b) Y forma íon de carga 4+ .
c) X é um metal do grupo 4 da Tabela Periódica.
d) o composto resultante da reação entre X e Y pode ter fórmula X2Y.
e) o composto formado por X e Y, ao reagir com água, forma uma base.
Questão 06. (Vunesp SP/2000). O magnésio pode ser obtido da água do mar. A etapa inicial deste processo envolve o tratamento da água do mar com óxido de cálcio. Nesta etapa, o magnésio é precipitado na forma de:
a) MgCl2 .
b) Mg(OH)2 .
c) MgO.
d) MgSO4 .
e) Mg metálico.
Questão 07 sobre Funções Químicas Bases: (ITA SP/1995) Em três frascos rotulados A, B e C e contendo 100 mL de água cada um, são colocados 0,1 mol, respectivamente, de hidróxido de potássio, hidróxido de cobre (II) e hidróxido de níquel (II). Após agitar o suficiente para garantir que todo soluto possível de se dissolver já esteja dissolvido, mede-se a condutividade elétrica das misturas. Obtém-se que as condutividades das misturas dos frascos B e C são semelhantes e muito menores do que a do frasco A.
Assinale a opção que contém a afirmação FALSA:
a) Nos frascos B e C, a parte do hidróxido que está dissolvida encontra-se dissociada ionicamente.
b) Os hidróxidos dos copos B e C são bases fracas, porque nem toda quantidade dissolvida está dissociada ionicamente.
c) A condutividade elétrica da mistura do frasco A é a maior porque se trata de uma solução 1 molar de eletrólito forte.
d) Os três solutos são bases fortes, porém os hidróxidos de cobre (II) e de níquel (II) são pouco solúveis.
e) Soluções muito diluídas com igual concentração normal destes 3 hidróxidos deveriam apresentar condutividades elétricas semelhantes.
Questão 08. (ITA SP/1995) Descreva como o hidróxido de sódio é obtido em escala industrial. Sua descrição deve incluir as matérias primas utilizadas, as equações das reações químicas envolvidas no processo, as condições de operação e o aproveitamento de eventuais subprodutos obtidos no processo.
Questão 09. (Unip SP/1993) A fórmula do hidróxido ferroso é:
a) Fe(OH)2
b) Fe(OH)3
c) FeO
d) Fe2O3
e) n.d.a
Questão 10 sobre Funções Químicas Bases: (Mackenzie SP/1994). A equação que representa corretamente a dissociação iônica de uma base pouco solúvel, de fórmula M(OH)x, é:
a) M(OH)x ® Mx+ + OH–
b) M(OH)x ® xM+ + xOH–
c) M(OH)x ® Mx+ + xOH–
d) M(OH)x ® Mx+ + OHx–
e) M(OH)x ® xM+ + OH-+
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Funções Químicas Bases:
01. E;
02. 01-V; 02-V; 04-F; 08-V; 16-F; 32-F;
03. E
RESOLUÇÃO
I- Falso. O produto é o CO2
II- Falso.
III- Falso. A turvação é devido à formação do BaCO3
IV- Falso.
V- Falso. A turvação ocorre devido:
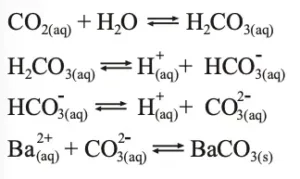
Após um prolongado borbulhamento do CO2 poderá ocorrer o desaparecimento da turvação devido:
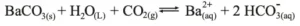
04. C;
A reação de síntese da amônia pode ser representada por:
N2(g) + 3H2(g) ® 2NH3(g)
O amoníaco é o nome popular do hidróxido de amônio (NH4OH ). Logo, as afirmações II e III são corretas.
05. E;
06. B;
07. D
RESOLUÇÃO
Os hidróxidos de Cobre – II e Níquel – II são fracos.
08. Processo:
O Hidróxido de sódio é obtido industrialmente por eletrólise de soluções aquosas de NaCl:
Matérias primas:
NaCl e H2O
Equações:
2NaCl + H2O ® 2NaOH + H2(g) + Cl2(g)
Sub-produtos
Hidrogênio gasoso: usado em outras reações químicas.
Cloro gasoso: aproveitado no para diversas outra reações como de cloração, obtenção de compostos para o tratamento de água etc.
09. A;
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
