Questões 01 sobre o Estudo das Pilhas: (PUC-Rio/2008) O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando e une uma meia-pilha onde a reação eletrolítica de redução ocorre espontaneamente (cátodo) com outra meia-pilha onde a reação eletrolítica de oxidação ocorre espontaneamente (ânodo).
Ag → Ag+ + 1 e– E = -0,80 V
Cu → Cu2+ + 2 e– E = -0,34 V
Cd → Cd2+ + 2 e– E = +0,40 V
Fe → Fe2+ + 2 e– E = +0,44 V
Zn → Zn2+ + 2 e– E = +0,76 V
Com base nas semirreações eletrolíticas acima, colocadas no sentido da oxidação, e seus respectivos potenciais, assinale a opção que indica os metais que produzirão maior valor de ddp quando combinados para formar uma pilha.
a) Cobre como cátodo e prata como ânodo.
b) Prata como cátodo e zinco como ânodo.
c) Zinco como cátodo e cádmio como ânodo.
d) Cádmio como cátodo e cobre como ânodo.
e) Ferro como cátodo e zinco como ânodo.
Questões 02. (PUC-Rio/2008) Considere o esquema a seguir que representa uma pilha constituída de metal cobre em solução aquosa de sulfato de cobre e metal cádmio em solução de sulfato de cádmio.
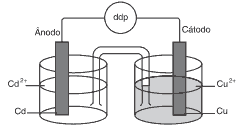
Uma tabela fornece a informação de que os potenciais-padrão de redução do Cu2+ e do Cd2+ são, respectivamente, +0,34 V e -0,40 V e que a prata é um elemento mais nobre que o cobre.
Assinale a opção que mostra a ordem decrescente de facilidade de oxidação dos três metais citados e a diferença de potencial (ddp) da pilha indicada na figura.
a) Cu > Ag > Cd; – 0,74 V.
b) Cd > Cu > Ag; + 0,74 V.
c) Ag > Cu > Cd; – 0,06 V.
d) Cd > Cu > Ag; + 0,06 V.
e) Ag > Cd > Cu; – 0,74 V.
Questões 03 sobre o Estudo das Pilhas: (UEL/2008) O município de Poços de Caldas, localizado no sul do Estado de Minas Gerais, é um importante centro turístico, mas tem, na produção do alumínio, extraído do mineral bauxita, um outro suporte econômico. A paisagem faz parte dos atrativos turísticos da região, embora afetada atualmente pela mineração que deixa o solo descoberto.
Quando isto ocorre em floresta nativa, o desafio do retorno da paisagem é muito complicado. O alumínio é obtido pela eletrólise ígnea de uma solução de óxido de alumínio puro (Al2O3), obtido da bauxita purificada, em criolita (Na3AlF6) fundida, mantendo a temperatura em aproximadamente 1.000°C.
Nestas condições, o óxido de alumínio se dissolve e a solução é boa condutora de eletricidade. Durante a eletrólise, os elétrons migram do íon oxigênio para o íon alumínio.
Em relação ao método de obtenção do alumínio, são feitas as afirmações:
I. Na solução, o Al2O3 está totalmente na forma não dissociada.
II. Na solução, o Al2O3 é o soluto e o Na3AlF6 é o solvente.
III. O alumínio é depositado no cátodo.
IV. A reação que ocorre no ânodo é a oxidação do O.
Assinale a alternativa que contém todas as afirmativas corretas.
a) I e II.
b) I e IV.
c) II e III.
d) I, III e IV.
e) II, III e IV.
Questões 04. (PUC-MG/2004) Assinale a alternativa que representa qualitativamente a evolução da concentração de Cu2+, no béquer 1, nos minutos iniciais de funcionamento dessa pilha.
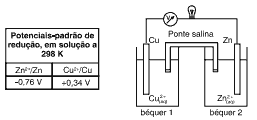
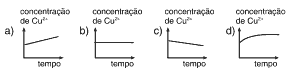
Questões 05 sobre o Estudo das Pilhas: É CORRETO afirmar que:

a) nas CNTP, a diferença de potencial da pilha considerada é 0,42 V.
b) o polo positivo da pilha é o eletrodo de zinco.
c) na ponte salina, a condução é eletrônica.
d) o eletrodo de cobre é o cátodo da pilha.
Questões 06. (PUC-RS/2004) Uma pilha utilizada nos marca-passos é constituída por um eletrodo de iodo e outro de lítio, e seu funcionamento é baseado nas seguintes semirreações adiante, cada uma representada com o respectivo potencial-padrão de redução.
I2(s) + 2 e– → 2 I–; E0= +0,536 V
Li+ + 1 e– → Li(s); E0= -3,045 V
Considerando-se essas informações, é correto afirmar que:
a) o eletrodo de lítio funciona como cátodo.
b) o eletrodo de iodo funciona como ânodo.
c) o I2 é o agente redutor.
d) o Li+ é o agente oxidante.
e) a diferença de potencial dessa pilha, em condições-padrão, é 3,581 V.
Questões 07 sobre o Estudo das Pilhas: (Fuvest/2012) Na década de 1780, o médico italiano Luigi Galvani realizou algumas observações, utilizando rãs recentemente dissecadas. Em um dos experimentos, Galvani tocou dois pontos da musculatura de uma rã com dois arcos de metais diferentes, que estavam em contato entre si, observando uma contração dos músculos, conforme mostra a figura:
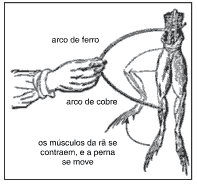
Interpretando essa observação com os conhecimentos atuais, pode-se dizer que as pernas da rã continham soluções diluídas de sais. Pode-se, também, fazer uma analogia entre o
fenômeno observado e o funcionamento de uma pilha.
Considerando essas informações, foram feitas as seguintes afirmações:
I. Devido à diferença de potencial entre os dois metais, que estão em contato entre si e em contato com a solução salina da perna da rã, surge uma corrente elétrica.
II. Nos metais, a corrente elétrica consiste em um fluxo de elétrons.
III. Nos músculos da rã, há um fluxo de íons associado ao movimento de contração.
Está correto o que se afirma em:
a) I, apenas.
b) III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
Questões 08. (Upf/2012) A corrosão metálica é a oxidação não desejada de um metal. Ela diminui a vida útil de produtos de aço, tais como pontes e automóveis, e a substituição do metal corroído
acarreta, todos os anos, grande gasto de dinheiro em todo o mundo. A corrosão é um processo eletroquímico, e a série eletroquímica nos dá uma indicação de por que a corrosão ocorre e como pode ser prevenida. Para a proteção de certas peças metálicas podem-se colocar pedaços de outro metal usado como metal de sacrifício. Assim, considerando alguns metais com seus respectivos potenciais-padrão de redução:
Mg2+ (aq) + 2e– → Mg(s) (E0 = -2,38 V)
Al3+ (aq) + 3e– → Al(s) (E0 = -1,68 V)
Zn2+ (aq) + 2e– → Zn(s) (E0 = -0,76 V)
Pb2+ (aq) + 2e– → Pb(s) (E0 = -0,13 V)
Cu2+ (aq) + 2e– → Cu(s) (E0 = +0,34 V)
Ag+(aq) + 1e– → Ag(s) (E0 = +0,80 V)
Qual o mais adequado para ser usado como metal de sacrifício se a peça a ser protegida for de alumínio?
a) Ag(s)
b) Zn(s)
c) Pb(s)
d) Cu(s)
e) Mg(s)
Questões 09. (Uespi/2012) Considere a tabela abaixo com os potenciais-padrão de redução e analise as afirmações a seguir.
Semirreação potenciais-padrão de redução, E0(V)
Cu+2 + 2 e– Cu +0,34
Pb+2 + 2 e– Pb –0,13
Ni+2 + 2 e– Ni –0,23
1. Quando uma placa de níquel metálico é mergulhada numa solução aquosa contendo íons Pb+2, ocorre deposição do chumbo metálico sobre a placa de níquel.
2. Quando um fio de cobre é mergulhado numa solução aquosa contendo íons Pb+2, ocorre deposição do chumbo metálico sobre o fio de cobre.
3. Numa pilha montada com os pares Ni+2 /Ni e Cu+2 /Cu, o eletrodo de cobre metálico funcionará como cátodo.
Está(ão) correta(s):
a) 1, 2 e 3
b) 1 e 2 apenas
c) 2 e 3 apenas
d) 1 e 3 apenas
e) 1 apenas
Questões 10 sobre o Estudo das Pilhas: (Ita/2011) Em um experimento de laboratório, cloreto de alumínio, cloreto de zinco e carbonato de sódio são dissolvidos, individualmente, em três recipientes separados contendo
água neutra aerada com pH = 7. Uma placa de ferro metálico é imersa em cada um dos recipientes, que são mantidos a temperatura de 25°C.
Admitindo-se as condições experimentais apresentadas acima, são feitas as seguintes afirmações em relação à influência da hidrólise dos sais na velocidade de corrosão das placas metálicas:
I. O cátion alumínio hidratado forma soluções aquosas que aceleram a corrosão do ferro.
II. As soluções aquosas produzidas pela hidrólise do ânion carbonato inibem a corrosão do ferro.
III. A corrosão do ferro é inibida pela solução aquosa formada no processo de hidrólise do cátion zinco hidratado.
Das afirmações acima, está(ao) correta(s) apenas
a) I e II.
b) I e III.
c) II.
d) II e III.
e) III.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de Química sobre o Estudo das Pilhas:
01. b;
02. b;
03. e;
04. c;
05. d;
06. e;
07. e;
08. e;
09. d;
10. a
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
