Questão 01 sobre Ligações Químicas: (CESGRANRIO) Assinale o composto que apresenta ligação de maior percentual de caráter iônico
a) HCl
b) NaCl
c) CsCl
d) KCl
e) LiCl
Questão 02. (UFMG-MG) O oxigênio e o enxofre formam, com o hidrogênio, respectivamente, as substâncias H2O e H2S. A 25°C e 1 atm de pressão, a água é líquida e o sulfeto de hidrogênio é gasoso. Considerando-se essas informações, é correto afirmar que,
a) A ligação covalente S-H ser mais forte que a O-H
b) A massa molar de H2S ser menor que a de H2O
c) A pressão de vapor de H2O ser menor que a de H2S
d) A temperatura de ebulição de H2S ser maior que a de H2O
Questão 03. (FUVEST) Dois metais, designados X e Y, reagem com cloro formando os compostos iônicos XCl e YCl. Os íons dos elementos X e Y devem, portanto, possuir igual:
a) Raio iônico
b) Carga elétrica
c) Número de prótons
d) Energia de ionização
e) Número de elétrons
Questão 04 sobre Ligações Químicas: (UFBA)
I. NH3
II. HF
III. SO2
IV. CH4
( ) linear
( ) angular
( ) piramidal
( ) tetraédrica
Associando-se as substâncias às respectivas estruturas, a coluna da direita deve ser preenchida pela sequência:
a) I, II, III, IV
b) I, III, I, IV
c) II, III, I, IV
d) II, IV, III, I
e) III. II, IV, I
Questão 05. (UFJF-MG) As substâncias químicas constituem parte fundamental da nossa vida. A respiração, a alimentação, a ingestão de água ou outros líquidos e o tratamento com medicamentos são alguns exemplos de atividades essenciais que envolvem compostos químicos formados por átomos ou íons que se unem uns aos outros. Assinale a resposta incorreta:
a) No sal (NaCl) que costumamos adicionar aos nossos alimentos, a ligação química é iônica
b) A molécula do gás oxigênio que inspiramos é composta de dois átomos que se unem através de ligação covalente polar
c) A molécula de gás carbônico que expiramos apresenta duas ligações duplas
d) As moléculas de água se unem uma ás outras através de ligação de hidrogênio
e) A grande maioria dos medicamentos é constituída de substâncias orgânicas, nas quais o tipo mais comum de ligação química presente é a covalente.
Questão 06 sobre Ligações Químicas: (UFSCar-SP) – Na classificação periódica, a coluna 1 refere-se aos elementos alcalinos e a coluna 17 refere-se aos halogênios. Metais alcalinos, como lítio, sódio e césio, reagem com gases halogênios, como Cl2. Os produtos das reações dos metais lítio, sódio e césio com o gás Cl2 são sólidos iônicos cujas fórmulas são, respectivamente,
a) LiCl2, NaCl, CsCl.
b) LiCl, NaCl2, CsCl.
c) LiCl2, NaCl2, CsCl2.
d) LiCl3, NaCl3, CsCl3.
e) LiCl, NaCl, CsCl.
Questão 07. (MODELO ENEM) – Em 1985, foi divulgada em uma publicação científica a descoberta de uma molécula tridimensional de carbono, na qual 60 átomos formam uma esfera com 12 pentágonos e 20 hexágonos, como uma bola de futebol. Em homenagem ao arquiteto e pensador norte americano Buckminster Fuller, a molécula foi denominada buckminsterfullerene ou simplesmente buckyball. A molécula C60 também é chamada de futeboleno.
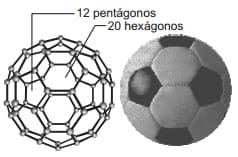
Os átomos de carbono estão unidos entre si por ligações caracterizadas pelo compartilhamento de pares de elétrons.
Portanto, os átomos de carbono no futeboleno ficam unidos por meio de uma ligação.
a) iônica
b) metálica
c) covalente
d) de hidrogênio
e) iônica e uma covalente
Questão 08. U. Católica-DF – Em relação ao cloreto de prata, pode-se afirmar que o tipo de ligação existente entre a prata e o cloro é:
a) covalente polar
b) covalente dativa
c) covalente apolar
d) metálica
e) iônica
Questão 09. Unifor-CE – Considere o texto abaixo.
Átomos de cloro, nas condições ambiente, não são estáveis. Reagem entre si formando a substância X Cl2, cuja ligação entre os átomos é Y Cloro (Cl2) reage com sódio formando o composto NaCl, cuja ligação entre os átomos é Z.
Completa-se corretamente o texto, substituindo-se X, Y e Z, respectivamente, por:
a) simples – covalente – iônica
b) simples – iônica – covalente
c) composta – covalente – metálica
d) composta – iônica – covalente
e) composta – covalente – iônica
Questão 10 sobre Ligações Químicas: U. Alfenas-MG – Analise as afirmativas abaixo:
I. A fórmula do composto formado por dois elementos químicos A e B, cujos subníveis mais energéticos no estado fundamental são respectivamente 4p5 e 4s1, é A3B.
II. Substâncias moleculares apolares de baixa massa molecular apresentam temperaturas de fusão elevadas.
III. Moléculas diatômicas de átomos iguais apresentam sempre ligações químicas covalentes apolares.
IV. No diamante, as ligações químicas existentes entre os átomos de carbono são covalentes apolares.
Estão corretas:
a) I, II, III e IV;
b) Somente I, II e III;
c) Somente II, III e IV;
d) Somente I, III e IV;
e) Somente III e IV;
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com respostas da lista de exercícios sobre Ligações químicas:
01. c;
02. c;
03. b;
04. c;
05. b;
06. E;
07. C;
08. E;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
