Questão 01 sobre Excessos: (Ufc CE/2008/2ªFase). O ácido fosfórico, H3PO4, pode ser produzido a partir da reação entre a fluoroapatita, Ca5(PO4)3F, e o ácido sulfúrico, H2SO4, de acordo com a seguinte equação química:
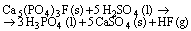
Considere a reação completa entre 50,45 g de fluoroapatita com 98,12 g de ácido sulfúrico.
a) Qual é o reagente limitante da reação?
b) Determine a quantidade máxima de ácido fosfórico produzida.
Questão 02. (Ufms MS/2008/Exatas) Elementos que podem expandir sua camada de valência comumente mostram covalência variável, ou seja, a habilidade de formar diferentes números de ligações covalentes. O fósforo (P4), por exemplo, reage com uma quantidade limitada de cloro (Cl2), formando um liquido tóxico incolor, denominado tricloreto de fósforo (PCl3). No entanto, se um excesso de cloro for adicionado, o tricloreto será convertido em pentacloreto de fósforo (PCl5), um sólido amarelo-claro. Com base nessas informações analise cada uma das proposições abaixo e assinale a(s) correta(s).
Dados: P(MA=31u; Z=9) e Cl(MA=35,5u; Z=17).
01. O cloro não é um fator limitante para a formação de pentacloreto de fósforo.
02. A primeira reação descrita ocorre na proporção de 1:6:4.
04. A molécula de PCl3 é formada por 3 ligações covalentes simples.
08. A segunda reação descrita ocorre na proporção de 1:10:4.
16. Partindo-se de 2,48 g de fósforo e de cloro suficiente, são formados 16,68 g de pentacloreto de fósforo.
Questão 03. (Uem PR/2007/Julho) Considerando a reação abaixo, responda as questões a, b e c.
2Na3PO4(aq) + 3Ba(NO3)2(aq) ![]() Ba3(PO4)2(s) + 6NaNO3(aq)
Ba3(PO4)2(s) + 6NaNO3(aq)
a) Quais os nomes dos reagentes?
b) Quantos gramas de Ba3(PO4)2(s) são formados quando se mistura uma solução contendo 3,28 g de Na3PO4 com uma solução contendo 7,83 g de Ba(NO3)2?
c) Se misturarmos quantidades de Na3PO4(aq) e Ba(NO3)2(aq) de modo a não haver sobras, ou seja, em proporção estequiométrica, e forem produzidos 2,04 kg de NaNO3(aq), qual será a quantidade de matéria produzida (em mols) de Ba3(PO4)2(s)?
Questão 04 sobre Excessos: (Unifesp SP/2007/1ªFase) O gás sulfeto de hidrogênio é uma substância que dá aos ovos podres o nauseabundo odor que exalam. Esse gás é formado na reação de um ácido forte, como o ácido clorídrico, HCl(aq), com sulfeto de sódio, Na2S. Considerando que a reação química se processa até consumir todo o reagente limitante, quando são transferidos para um recipiente 195 g de sulfeto de sódio, 584 g de ácido clorídrico a 25% em massa e água destilada, a quantidade produzida de sulfeto de hidrogênio, em gramas, é igual a
a) 779.
b) 683.
c) 234.
d) 85.
e) 68.
Questão 05 sobre Excessos: (Ufc CE/2007/1ªFase). Quando o dióxido de enxofre reage com cloro (ambos gasosos), originam-se dois produtos: o cloreto de tionila (SOCl2) e o monóxido de cloro (OCl2). Com relação a essa reação, é correto afirmar que:
a) o SOCl2 possui geometria molecular em gangorra.
b) um ácido de Brönsted reage com uma base de Brönsted.
c) o oxigênio possui maior raio atômico entre os elementos presentes.
d) o enxofre varia seu estado de oxidação de –4 nos reagentes para +4 nos produtos.
e) o cloro é o reagente limitante quando 12,8 g de dióxido de enxofre reagem com 14,2 g de cloro com 100% de rendimento.
Questão 06. (Furg RS/2007). Considere a seguinte reação não balanceada:
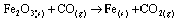
Quando 5 mols de Fe2O3 reagem com 16 mols de CO com um rendimento de 100%, pode-se afirmar que o reagente limitante e o número de átomos de Fe formados, respectivamente, nesta reação, serão:
a) CO, e são formados 90,30×1023 átomos de Fe.
b) Fe2O3, e são formados 6,02×1023 átomos de Fe.
c) Fe2O3, e são formados 60,24×1023 átomos de Fe.
d) CO, e são formados 72,24×1023 átomos de Fe.
e) Fe2O3, e são formados 24,08×1023 átomos de Fe.
Questão 07 sobre Excessos: (Ufes ES/2007) A produção industrial de ácido sulfúrico ocorre da seguinte forma:
I) queima do enxofre elementar na presença do oxigênio, dando origem ao dióxido de enxofre;
II) o dióxido de enxofre formado reage com oxigênio para formar o trióxido de enxofre;
III) o trióxido de enxofre formado reage com a água formando, finalmente, o ácido sulfúrico.
Pede-se:
a) Escreva a reação química balanceada que ocorre nos processos (I), (II) e (III), respectivamente.
b) O SO2 formado na queima de 6,4 gramas de enxofre, ao reagir com Ba(OH)2, em excesso, produziu um sal, que se precipitou. Determine a massa do sal formado na reação.
Questão 08 sobre Excessos: (Uem PR/2006/Janeiro) Misturou-se uma solução aquosa que possui 8,00 g de hidróxido de sódio (dissolvido) com outra solução aquosa que possui 10,8 g de ácido sulfúrico (dissolvido). Após se completar a reação de neutralização, responda:
(Dados: Na = 23; O = 16; H = 1; S = 32)
a) Quantos gramas de sal foram produzidos?
b) Quantos gramas de água foram produzidas?
c) Quantos gramas sobrou do reagente em excesso?
Questão 09. (Fuvest SP/2006/1ªFase) O tanque externo do ônibus espacial Discovery carrega, separados, 1,20 x 106 L de hidrogênio líquido a –253 ºC e 0,55 x 106 L de oxigênio líquido a –183 ºC. Nessas temperaturas, a densidade do hidrogênio é 34mol/L (equivalente a 0,068 g/mL) e a do oxigênio é 37mol/L (equivalente a 1,18 g/mL).
Dados:
H = 1,0; O =16
Considerando o uso que será feito desses dois líquidos, suas quantidades (em mols), no tanque, são tais que há
a) 100% de excesso de hidrogênio.
b) 50% de excesso de hidrogênio.
c) proporção estequiométrica entre os dois.
d) 25% de excesso de oxigênio.
e) 75% de excesso de oxigênio.
Questão 10 sobre Excessos: (Unesp SP/2006/Conh. Gerais). Um químico deseja preparar hidrazina (N2H4) através da reação de 3,6 mol de NH3 com 1,5 mol de OCl-. A reação química é dada pela equação:
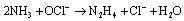
O número de mols de hidrazina obtido é
a) 1,5.
b) 1,8.
c) 2,1.
d) 3,6.
e) 5,1.
Confira nossas outras listas de exercícios sobre os cálculos estequiométricos:
- Exercícios sobre Mol e Cálculos Estequiométricos;
- Simulado sobre Cálculos Estequiométricos e Excessos;
- 10 Questões sobre Cálculos Estequiométricos;
- Questões de química sobre Cálculos Estequiométricos.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com 10 exercícios sobre Excessos em Cálculos Estequiométricos:
Gabarito do Exercício 01:
a) fluoroapatita ![]() é o reagente limitante da reação.
é o reagente limitante da reação.
b) 29,41gH3PO4
Gabarito do Exercício 02: 022;
Gabarito do Exercício 03: a) Na3PO4 e Ba(NO3)2
b) 6,01g
c) 4 mol
Gabarito do Exercício 04:E;
Gabarito do Exercício 05: E;
Gabarito do Exercício 06: C;
Gabarito do Exercício 07:
a) A reação química balanceada que ocorre no processo (i), (ii) e (iii):
i) S(s) + O2(g)→ SO2(g)
ii) SO2(g) + ½O2(g)→ SO3(g)
iii) SO2(g) + H2O(l)→ H2SO4(aq)
b) A massa do sal formado será:
S(s) + O2(g)→ SO2(g)
32,0 gramas → 64,0 gramas
6,4 gramas → X .: X = 12,8 gramas
SO2(g) + Ba(OH)2(aq) ![]() BaSO3(aq) + H2O(l)
BaSO3(aq) + H2O(l)
64,0 gramas → 217,4 gramas
12,8 gramas → y .: y = 43,5 gramas
Gabarito do Exercício 08:
a) 14,2g ;
b) 3,6g ;
c) 1g H2SO4
Gabarito do Exercício 09: C;
Gabarito do Exercício 10: A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
